CGT产品技术评价体系日趋完善
发布日期:2022-08-30 阅读次数:14079 来源:中国医药报
摘要:
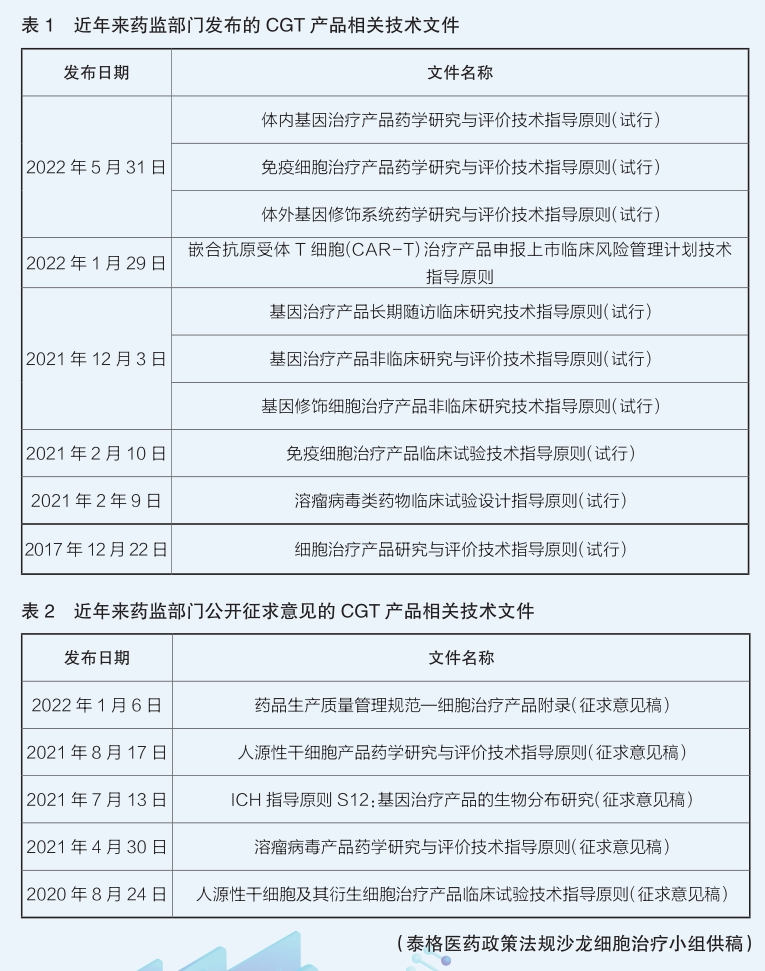
细胞与基因治疗产品的技术特征与传统药品有显著区别,无法照搬传统药物开发的技术评价思路。让业界为之振奋的是,我国药品监管部门对CGT领域也十分重视。2019年4月,国家药监局启动了中国药品监管科学行动计划,首批研究项目包括“细胞和基因治疗产品技术评价与监管体系研究”,该项目通过发布一系列技术指南,建设和完善该领域的技术评价体系。
目前,国家药监部门已发布多项技术指导原则。比如,2021年12月发布的《基因修饰细胞治疗产品非临床研究技术指导原则(试行)》基于基因修饰细胞治疗产品的特点和临床应用中安全性风险的关注点,框架性地提出了此类产品的非临床研究目的、非临床安全性评价策略制定时的主要考虑因素、受试动物、动物种属/模型选择等要求。在临床研究方面,2021年2月发布的《免疫细胞治疗产品临床试验技术指导原则(试行)》对以在国内注册上市为目的进行研发和注册申报的免疫细胞治疗产品,在临床试验的总体规划、试验方案设计、试验实施和数据分析等方面提供了必要的技术指导。在药学方面,自2020年下半年起陆续发布了若干技术指导原则,对基因治疗产品和细胞治疗产品(含人源性干细胞和免疫细胞治疗产品)的药学研发给出较为全面的指导意见。此外,在细胞治疗产品的质量管理方面,今年1月向社会公开征求意见的《药品生产质量管理规范—细胞治疗产品附录(征求意见稿)》基于细胞产品的特殊性,提出企业从供者材料采集和产品生产的全过程应采取特殊控制措施。
这些指导原则的发布,初步搭建了CGT产品临床研究和审评的技术框架,是建立科学规范的产品评价体系的基础。随着生命科学和医学研究的快速发展,CGT产品已显示出巨大的应用潜力,有望尽快满足患者的临床需求。














