细胞与基因治疗领域研发加速崛起
发布日期:2022-08-30 阅读次数:15064 来源:中国医药报
摘要:
2015年以来,全球细胞与基因治疗领域(Cell and Gene Therapy,CGT)研发速度不断加快。根据美国细胞和基因治疗协会(ASCGT)的统计,当前在美国临床试验注册库Clinicaltrials.gov上登记的CGT相关临床试验有2483项。
细胞与基因治疗行业也愈发受到资本市场的青睐,私募融资、IPO、并购、合作等多种交易形式蓬勃发展。根据海通国际的行业报告,2021年全球CGT领域融资总额已达到225亿美元。
市场规模扩大 融资并购活跃
细胞与基因治疗是利用基因治疗载体,将外源的治疗性基因转导至细胞,再通过外源基因的转录和翻译,改变细胞原有基因表达以治疗疾病的方法。作用方式一般包括:用正常基因替代致病基因;使致病基因失活;导入新的或经过改造的基因。治疗药物主要包括基因治疗载体产品、基因修饰的细胞产品,以及具有特定功能的溶瘤病毒产品。作为继小分子、大分子靶向疗法之后的新一代精准疗法,CGT为肿瘤、罕见病、慢性病及其他难治性疾病提供了新的治疗理念和手段。
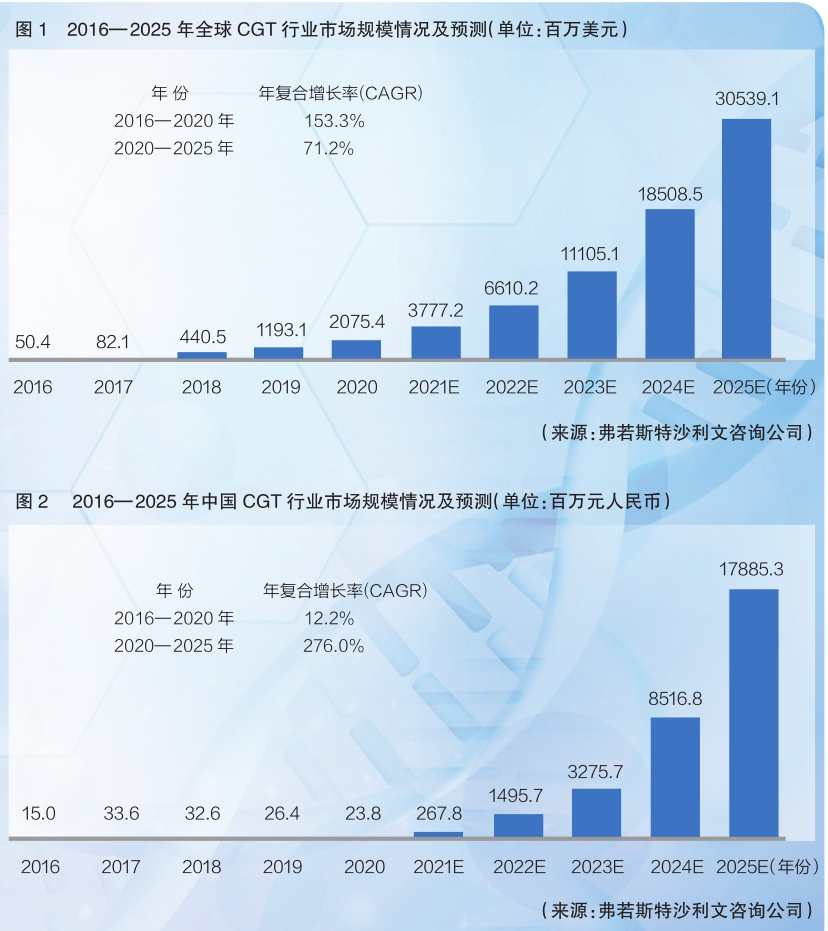
根据弗若斯特沙利文咨询公司的分析,2016—2020年,CGT领域市场规模从5040万美元增长到20.8亿美元;预计到2025年,全球CGT市场规模将达到近305.4亿美元(详见图1)。
中国的CGT市场规模在2016—2020年期间从1500万元增长到了2380万元,增长幅度尚不明显。但随着近年来相关临床试验的大量开展以及CGT产品的陆续获批上市,预计国内市场规模将快速扩大,到2025年将达到178.9亿元(详见图2)。
伴随着全球CGT行业的快速发展,融资活动也日渐活跃。特别在2017年以后,随着基因疗法Luxturna和2款CAR-T药物Kymriah和Yescarta的上市,行业融资总额已从2017年的约75亿美元大幅增长至2020年的199亿美元。
目前,虽然中国生物医药产业正处于“资本寒冬”期,但资本对CGT仍颇为青睐。据研发客统计,2022年1月国内发生的融资中,细胞和基因疗法研发领域的公司收获颇多,占所有已披露资金的29%。其中克睿基因(Cure Genetics)获得了6000万美元的B轮融资。
2022年2月,CGT相关公司继续保持优势,在21笔融资交易中占据了11个席位,预计这一趋势将持续全年。
全球已上市二十款药物 在研产品数超两千
据研发客统计,截至目前,全球已上市的CGT药物共有20款(不包括RNA疗法)。其中最新一款产品为刚刚获得欧盟委员会上市许可的Upstaza,来自美国PTC Therapeutics公司。
Upstaza是第一个获批的针对芳香族L-氨基酸脱羧酶(AADC)缺乏症的体内基因疗法,可用于治疗年龄为18个月及以上的患者,它也是第一个直接注入大脑的已上市基因疗法。该疗法以2型腺相关病毒(AAV2)为载体,患者由于编码AADC酶的基因出现突变而致病,AAV2携带编码AADC酶的健康基因,以基因补偿的形式达到治疗效果,理论上一次给药长期有效。
目前在中国获批上市的CGT药物共有4款,包括两款溶瘤病毒产品、两款CAR-T产品。2021年6月,国家药监局批准了中国首款CAR-T产品阿基仑赛注射液;同年9月,中国首款自主研发的CAR-T产品瑞基奥仑赛注射液获批上市。两款产品均用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。
在研品种数量则庞大得多。在技术、资本和政策的驱动下,全球CGT行业快速升温,大量治疗药物研发进入临床研究阶段。根据ASGCT的数据,截至2022年第二季度,共有2024款CGT产品在研。其中,258款产品处于临床试验Ⅰ期,248款产品处于临床试验Ⅱ期,28款产品处于临床试验Ⅲ期,8款产品已递交上市申请(其中Upstaza现已获批),有1482个品种处于临床前研究阶段。
2000余款在研产品中,CAR-T产品占比最大(48%),其次是TCR-T、CAR-NK等产品。绝大多数品种聚焦于肿瘤和罕见病领域。排名前五位的热门适应症为:骨髓瘤、非霍奇金淋巴瘤、急性骨髓性白血病、B细胞淋巴瘤和卵巢癌。其他适应症分布在血液系统疾病、内分泌系统疾病和代谢性疾病、神经系统疾病、免疫系统疾病等领域。
国内超百家公司布局 传统药企和创新企业加速角逐
国内CGT公司主要专注于CAR-T、TCR-T等免疫细胞产品,以及基因修饰溶瘤病毒产品的研发,治疗领域为血液瘤、淋巴系统肿瘤、实体瘤等。目前,布局CGT领域的公司超过100家,其中既有为丰富管线而在此布局的传统药企,亦不乏以CGT为主营方向的创新型企业。
以专注于基因编辑疗法的博雅辑因为例,目前其管线中进展最快的是ET-01。这是一款CRISPR/Cas9基因修饰BCL11A红系增强子的自体CD34+造血干祖细胞注射液。ET-01是处于临床研发阶段的、自体的、体外基因编辑细胞疗法研究产品,用于治疗输血依赖型β地中海贫血。ET-01是中国首个获批开展临床试验的基因编辑疗法和造血干细胞疗法研究产品,目前正处于国内多中心Ⅰ期临床试验阶段。
传奇生物是国内细胞治疗研发型公司的第一梯队公司,其首款产品西达基奥仑塞已在美国、欧盟上市,用于多发性骨髓瘤的治疗。除血液肿瘤外,传奇生物还在开展CAR-T用于实体瘤治疗的研究。今年6月,美国FDA批准了其产品LB1908在美国进行Ⅰ期临床试验的IND申请。LB1908是一种通过高亲和力VHH抗体选择性靶向Cl audin 18.2的CAR-T疗法,用于治疗复发性或难治性胃癌、食管癌(包括胃食管连接部)或胰腺癌成人患者。此外,一项由研究者发起的评估LB1908治疗晚期胃癌的Ⅰ期临床试验也在中国同步进行。 (研发客供稿)














