7月份中美欧批准上市新药盘点
发布日期:2022-08-24 阅读次数:13543 来源:中国食品药品网
摘要:
7月份,中美欧共批准6款新药上市。其中,中国和欧盟各有3款新药获批,美国无新药获批。
我国批准3款新药上市
7月份,我国共批准3款新药上市(详见表1),其中附条件批准的普特利单抗为我国药企乐普生物自主研发。

普特利单抗是通过使用人IgG4亚型针对人PD-1的人源化单抗。它可以拮抗PD-1信号,通过阻断PD-1与其配体PD-L1、PD-L2的结合来恢复免疫细胞杀死癌细胞的能力,用于既往接受一线及以上系统治疗失败的微卫星高度不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤患者的治疗。同时,普特利单抗采用抗体工程技术,于Fc区引入突变,提高FcRn受体的结合亲和力,从而大幅延长其半衰期,提高患者的临床疗效及药物依从性。在2021年美国临床肿瘤学会(ASCO)会议上,乐普生物公布了普特利单抗用于MSI-H/dMMR实体瘤的多中心Ⅱ期临床试验结果。结果显示,在纳入的100名二线及以上患者中,86例达到初步反应评价。研究主要终点客观缓解率(ORR)达到47.67%,疾病控制率(DCR)为75.58%,6个月和12个月无进展生存期(PFS)率分别为62.66%和52.70%。
恩曲替尼是罗氏研发的针对NTRK和ROS1基因融合而设计的特异性酪氨酸激酶抑制剂。NTRK融合阳性肿瘤产生的原因是NTRK1/2/3基因与其他基因融合,导致编码的TRK蛋白(TRKA/B/C)出现异常,激活与特定癌症增殖相关的信号通路。NTRK基因融合可能出现在起源于身体不同位置的肿瘤中,包括乳腺癌、胆管癌、非小细胞肺癌等。恩曲替尼治疗NTRK融合阳性局部晚期或转移性实体瘤的效果,已在多项临床试验中证明对多达10种不同类型的实体瘤患者有响应。
曲拉西利是先声药业引进的由美国公司G1 Therapeutics开发的一款短效细胞周期蛋白依赖性激酶4和6(CDK4/6)抑制剂。CDK4/6被认为是驱动细胞分裂的关键调节因子,它通过与一类叫细胞周期蛋白(cyclinD)的蛋白质结合,磷酸化视网膜母细胞瘤蛋白(Rb),释放转录因子E2F,进而促进细胞周期相关基因的转录,使细胞周期从DNA合成前期(G1期)进入到DNA复制期(S1期)。曲拉西利通过短暂的G1期阻滞,降低骨髓造血干细胞的复制负担,从而缓解骨髓造血干细胞的耗竭。曲拉西利曾获美国食品药品管理局(FDA)授予突破性疗法认定和优先审评资格,并于2021年2月获FDA批准上市。2020年8月,先声药业与G1 Therapeutics达成授权合作,获得了在大中华区对曲拉西利所有适应症的开发和商业化权益。
欧盟批准3款新药上市
根据Pharmadigger数据库数据,7月份,欧盟共批准3款新药上市(详见表2)。其中,Eladocagene exuparvovec为全球首次获批。
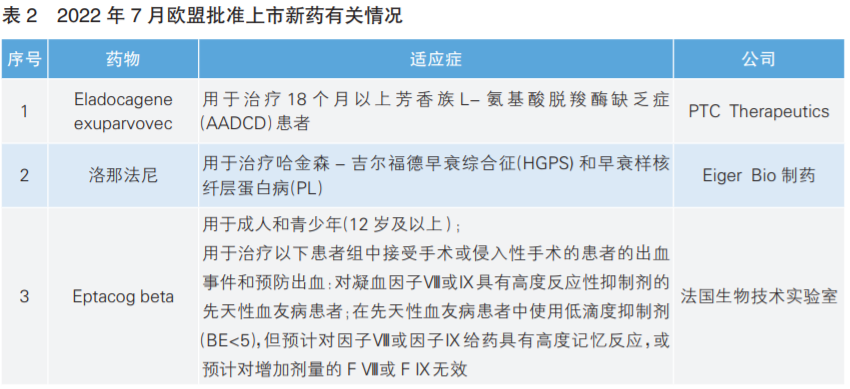
Eladocagene exuparvovec是美国公司PTC Therapeutics开发的基于腺相关病毒2(AAV2)载体并能直接注入大脑的首款获批基因疗法,用于治疗18个月以上芳香族L-氨基酸脱羧酶缺乏症(AADCD)患者。AADCD是一种致命的罕见遗传病,患者由于编码AADC酶的多巴脱羧酶(DDC)基因出现变异,导致AADC酶功能缺失。通常患者出生几个月内就会出现严重运动障碍,包括运动功能减退、肌张力障碍等,严重影响生活。这一基因疗法通过一次性治疗,将功能正常的DDC基因直接递送到患者大脑的壳核中,从而提高AADC酶的水平并恢复多巴胺的生产。
洛那法尼是美国制药公司Eiger Bio研发的一种口服法尼基转移酶抑制剂,其通过抑制早衰蛋白的异戊二烯化,进而降低早衰蛋白在细胞核中的积累,用于一种极罕见且具有致命性的遗传病——早衰症的治疗。该药最早于2020年11月获得美国FDA批准上市。
Eptacogbeta是法国生物技术实验室研发的重组人凝血因子Ⅶa类似物。该药物最早于2020年4月获得美国FDA批准上市。














