新型偶联药物研发多“管”齐下
发布日期:2022-08-08 阅读次数:11708 来源:中国医药报
摘要:
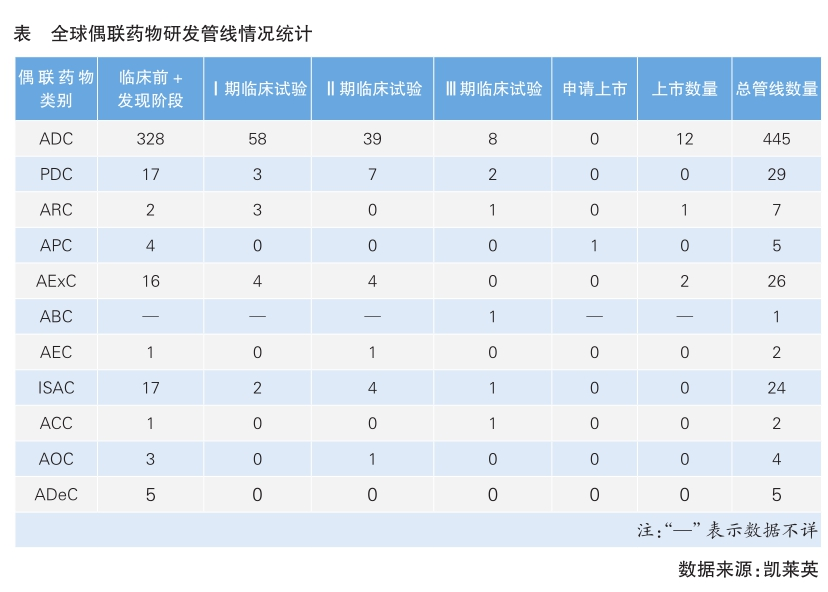
随着2019年以来全球范围内多款抗体偶联药物(ADC)相继获批,偶联药物已发展为制药行业最热门的赛道之一。除了传统的ADC药物以外,多肽偶联药物(PDC)、抗体-放射性核素偶联物(ARC)、抗体-光敏剂偶联物(APC)、抗体-细菌外毒素偶联物(AExC)、抗体-生物聚合物偶联物(ABC)、抗体-酶偶联物(AEC)、抗体-免疫刺激偶联物(ISAC)、抗体-细胞偶联物(ACC)、抗体-寡核苷酸偶联物(AOC)、抗体-降解子偶联物(ADeC)等新型偶联药物(NDC)的全球研发热度也很高(全球偶联药物研发管线情况统计详见表)。
PDC
PDC由连接子、归巢肽以及具有细胞毒性的有效载荷构成,靶向肽可以特异性靶向肿瘤细胞表面过表达的蛋白受体从而传递细胞毒素,诱导肿瘤细胞凋亡。相比于目前已上市ADC药物,PDC药物具有分子量小、肿瘤穿透性强、免疫原性低、利用固相合成法可大规模合成、生产成本不高、药代动力学相对较好等特点。
从研发管线上看,目前该领域最高研发阶段为Ⅲ期临床试验,代表药物有由加拿大AngioChem公司和我国药企盛诺基联合开发的Paclitaxel trevatide(SNG1005)、由美国Aeterna Zentaris公司和国药一心联合开发的Zoptarelin doxorubicin(AEZS-108)。SNG1005是一款穿透血脑的多肽药物偶联物,由紫杉醇与氨基酸短肽偶联得到,能够将紫杉醇特异性递送至脑部。Ⅱ期临床试验结果显示,在治疗乳腺癌脑软膜转移癌和复发性乳腺癌脑实质转移癌中,SNG1005都显示出积极的临床治疗效果。AEZS-108是促黄体激素释放激素(LHRH)激动剂与阿霉素的结合物,目前正在去势抵抗性前列腺癌患者中进行临床试验。
ARC
ARC的代表药物有日本IDEC公司研发的Ibritumomab tiuxetan(Zevalin)。Zevalin将携带放射性核素的抗CD20单抗药物注入患者体内后,会与表达CD20的成熟B细胞和B细胞肿瘤细胞结合,通过放射性核素释放的放射线来杀死这些细胞。此外,由美国ImmunoGen公司和中美华东联合开发的Mirvetuximab soravtansine(MIRV)也是ARC代表药物之一。该药物与叶酸受体(FRα)结合后转移到细胞内部,携带的细胞毒性分子DM4便可抑制癌细胞的有丝分裂,达到治疗癌症的效果。MIRV被开发用于治疗FRα高表达的铂类耐药卵巢癌,属于创新药。
APC
APC的代表药物是由日本乐天医疗公司开发的Cetuximab sarotalocan(Akalux),于2020年9月获日本厚生劳动省加速批准。Akalux是由西妥昔单抗与IRDye700DX构成的抗体偶联药物,可靶向表皮生长因子受体,用于不可切除的局部晚期或局部复发性头颈癌治疗,为全球首个获批的光免疫疗法药物。
AExC
AExC的代表药物是阿斯利康的Moxetumomab pasudotox,是CD22的单克隆抗体和假单孢菌外毒素(PE38)的偶联物,已被美国食品药品管理局(FDA)批准用于毛细胞白血病(HCL)的治疗。另一个代表药物是瑞士药企ADC Therapeutics开发的Loncastuximab tesirine,由人源化抗CD19抗体和Pyrrolobenzodiazepine二聚体毒素SG3199组成,2021年4月获得FDA批准用于治疗弥漫性大B细胞淋巴瘤。
ABC
ABC的代表药物是由美国Kodiak Sciences公司开发的KSI-301。KSI-301是基于该公司专有的ABC技术平台开发的一种新型抗VEGF生物制剂,被设计用于延长药物在眼组织内的持续时间,以此提高疗效、减少注射次数。2022年2月,Kodiak Sciences公布湿性年龄相关黄斑变性KSI-301首个注册临床试验DAZZLE数据,结果显示,该药物对于视力矫正较阿柏西普未显示非劣,未达到临床终点。Kodiak Sciences研究人员分析认为,此次临床试验失败的一个重要原因是方案用药间隔时间过长。
AEC
AEC的代表药物为加拿大Helix BioPharma公司开发的靶向CEACAM6(在多种上皮恶性肿瘤中过表达)的L-DOS47。L-DOS47是基于该公司DOS47技术开发的第一个靶向治疗免疫偶联物,包括一种高度专业化的骆驼衍生单域抗体。其中,脲酶成分将天然存在的尿素酶促转化为氨,目前正在开发用于治疗非小细胞肺癌(NSCLC)和胰腺癌。
ISAC
ISAC的代表药物是由美国公司Bolt Biotherapeut ics开发的BDC-1001。该药物由抗HER-2曲妥珠单抗生物类似药,通过非可降解连接子与TLR 7/8双激动剂偶联,用于治疗HER2阳性实体瘤。2021年12月,Bolt Therapeutics在欧洲肿瘤内科学会年会上公布了BDC-1001的1/2期临床数据:在40例可评估患者中,1例PR(部分缓解),12例SD(疾病稳定),ORR(总缓解率)仅2.5%,DCR(疾病控制率)为32.5%。
ACC
ACC的代表药物是基于美国Acepodia公司开发的ACE1702,目前该药物处于Ⅰ期临床试验阶段。在体内和体外研究中,ACE1702均显示出增强肿瘤细胞杀伤活性。在GLP毒理学研究中,ACE1702也保持了良好的安全性。
AOC
AOC的代表药物是由美国Avidity Biosciences公司开发的AOC-1001。该药物结合了单克隆抗体的组织选择性和寡核苷酸治疗方法的精确性,克服了阻碍寡核苷酸传递的障碍和靶向疾病的遗传驱动因素,用于治疗罕见的肌肉疾病和其他严重疾病。进入临床试验的AOC-1001由3部分组成:靶向转铁蛋白受体1(Tf R1)的全长单抗、连接子、靶向DMPK mRNA的siRNA。
ADeC
ADeC目前处于早期研发阶段。其技术原理是将蛋白质降解剂作为有细胞毒性的小分子药物,兼具ADC的肿瘤特异性和PROTAC分子(蛋白水解靶向嵌合分子)催化剂量下对低表达的适用性,用于治疗实体瘤。代表药物是由韩国Orum Therapeutics公司开发的ORM-5029。
相关新闻

医学科普,听得懂更要讲得对
新一轮科技革命推动医学科技迅速发展,新装备、新技术、新药、新方案等已深度影响“促、防、诊、控、治、康”各环节,这也为健康科普提供了高水平的传播内容和传播载体。医学科普是以通俗易懂的方式将健康领域的科技知识、科学方法、科学思想和科学精神传播给公众,旨在培养公众的健康素养,帮助公众学会自我健康管理的长期性活动。建设健康中国,医学科普工作具有重要意义和独特作用。
14496个小时之前


基于质量源于设计路线的生物类似药质量研究
29544个小时之前

浅谈AI技术在COVID-19诊疗中的应用
29711个小时之前

“OK镜”市场迎来变数 疗效及安全备受关注
29711个小时之前













